医院动态
JAMA Neurology | 注射用重组人尿激酶原治疗发病4.5h时间窗内急性轻型缺血性卒中(PUMICE)在线发表
2025年1月22日,首都医科大学附属北京天坛医院神经病学中心王拥军教授团队在JAMA Neurology发表题为《Prourokinase vs Standard Care for Patients With Mild Ischemic Stroke》临床试验,神经病学中心熊云云教授和国家神经系统疾病临床医学研究中心孟霞教授为论文的共同第一作者,王拥军教授为独立通讯作者。

在真实世界中,约半数急性缺血性卒中患者表现为轻度神经功能缺损[1]。然而,在这部分轻型卒中患者中,多达15%的患者可能会出现早期症状恶化[2]。90天时约15%的轻型卒中患者会面临致残风险,更有4%的患者面临死亡风险[3,4]。既往的PRISMS(r-tPA治疗轻型缺血性卒中)试验及ARAMIS(抗血小板对比 r-tPA 治疗急性轻型缺血性卒中)试验均表明与抗血小板药物相比,静脉注射阿替普酶对轻型卒中患者没有获益,反而在数量上增加了出血风险[5,6]。2024年在Lancet杂志上发表的TEMPO-2(轻型缺血性卒中伴动脉闭塞患者使用替奈普酶对比标准药物治疗)研究表明在轻型卒中患者中使用替奈普酶溶栓无获益,还可能增加死亡风险[7]。尽管指南建议对轻型致残性卒中使用静脉溶栓药物[8,9],但没有单独针对轻型卒中患者的试验证明其获益。此外,在急诊的临床诊疗工作中,评估并区分致残性和非致残性神经功能缺损具有挑战性。
注射用重组人尿激酶原作为一种特异性纤溶酶原激活剂,具有出血风险较低的潜在优势[10],已被证实在发病4.5小时内的中重度缺血性卒中患者中,其疗效非劣效于阿替普酶,且具有更好的安全性[11]。目前尚不清楚尿激酶原对轻型卒中患者是否有益,因此PUMICE试验旨评估在症状出现后4.5小时内,尿激酶原静脉溶栓对轻型缺血性卒中(NIHSS 评分≤5分)患者的有效性和安全性。
PUMICE试验是由首都医科大学附属北京天坛医院王拥军教授团队发起的一项多中心、前瞻性、开放标签、终点盲法、随机对照的 III期临床试验。主要纳入发病4.5小时内、NIHSS评分≤5分,且不准备行血管内治疗的急性缺血性卒中患者。安全性结局包括36小时症状性颅内出血率、90天死亡率、90天任何部位中重度出血发生率等。
符合条件的患者被1:1随机分配到注射用重组人尿激酶原(总剂量35 mg,其中15mg在最初不少于3分钟内静脉推注,剩余20mg在随后不少于半小时内静脉滴注)静脉溶栓组或标准药物治疗组(抗血小板治疗或抗凝治疗),试验共纳入89家研究中心1446例患者,尿激酶原组和标准药物治疗组各723人。主要结果提示尿激酶原组90天mRS 0-1分比例对比标准药物治疗组无显著统计学差异(88.5% vs. 91.0%;RR 0.97;95% CI 0.94 - 1.01;双侧P=0.12)。次要终点上尿激酶原组早期神经功能改善比例显著增高(55.7 vs. 44.3; RR 1.26; 95%CI 1.13-1.40; P< 0.001)。安全性上,尿激酶原组和标准药物治疗组36小时症状性颅内出血发生率分别为0.7%和0%(Fisher精确检验P=0.06),90天死亡率分别为 2.3%和1.4%(RR 1.69;95% CI 0.78 - 3.66),90天任何部位中重度出血发生率分别为0.8%和0.1%(RR 5.95;95% CI 0.72 - 49.4),均无统计学差异。
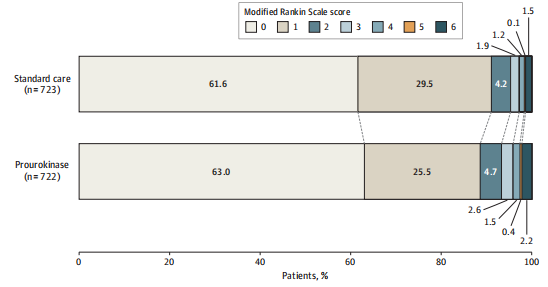
图2 PUMICE研究mRS分布图
PUMICE试验证明,对于发病后4.5小时内的轻型缺血性卒中患者,尿激酶原在改善功能预后方面尚不优于标准药物治疗,但显著增高早期神经功能改善比例,具有良好的安全性。目前指南仅建议对发病4.5小时内的轻型致残性卒中使用静脉溶栓药物,但证据等级不高,PUMICE试验可能成为轻型卒中患者静脉溶栓治疗领域决定性结论的试验并将推动国内外指南进一步更新。

王拥军,神经病学教授,主任医师,首都医科大学附属北京天坛医院院长、国家神经系统疾病医疗质量控制中心主任、国家神经系统疾病临床医学研究中心副主任、北京脑保护高精尖创新中心主任、中华医学会神经病学分会主任委员、Stroke & Vascular Neurology杂志主编。国家十二五科技支撑计划脑血管病领域首席专家、国家十三五重点研发专项非传染性慢病领域首席专家、国家重大新药创制科技重大专项总体专家组成员。近5年以第一或通讯作者在NEJM、JAMA、BMJ等期刊发表论文发表SCI论文400余篇。以第一完成人获国家科技进步奖二等奖2项、省部级一等奖2项,获首批全国创新争先奖章与中源协和生命医学成就奖。
参考文献
1. Xiong Y, Gu H, Zhao X-Q, et al. Clinical Characteristics and In-Hospital Outcomes of Varying Definitions of Minor Stroke: From a Large-Scale Nation-Wide Longitudinal Registry. Stroke. 2021;52(4):1253-1258.
2. Smith EE, Abdullah AR, Petkovska I, Rosenthal E, Koroshetz WJ, Schwamm LH. Poor outcomes in patients who do not receive intravenous tissue plasminogen activator because of mild or improving ischemic stroke. Stroke. 2005;36(11):2497-2499.
3. Khatri P, Conaway MR, Johnston KC. Ninety-day outcome rates of a prospective cohort of consecutive patients with mild ischemic stroke. Stroke. 2012;43(2):560-562.
4. Tan Y, Pan Y, Liu L, Wang Y, Zhao X, Wang Y. One-year outcomes and secondary prevention in patients after acute minor stroke: results from the China National Stroke Registry. Neurol Res. 2017;39(6):484-491.
5. Khatri P, Kleindorfer DO, Devlin T, et al. Effect of Alteplase vs Aspirin on Functional Outcome for Patients With Acute Ischemic Stroke and Minor Nondisabling Neurologic Deficits: The PRISMS Randomized Clinical Trial. JAMA. 2018;320(2):156-166.
6. Chen H-S, Cui Y, Zhou Z-H, et al. Dual Antiplatelet Therapy vs Alteplase for Patients With Minor Nondisabling Acute Ischemic Stroke: The ARAMIS Randomized Clinical Trial. JAMA. 2023;329(24):2135-2144.
7. Coutts SB, Ankolekar S, Appireddy R, et al. Tenecteplase versus standard of care for minor ischaemic stroke with proven occlusion (TEMPO-2): a randomised, open label, phase 3 superiority trial. Lancet. 2024;403(10444):2597-2605.
8. Powers WJ, Rabinstein AA, Ackerson T, et al. Guidelines for the Early Management of Patients With Acute Ischemic Stroke: 2019 Update to the 2018 Guidelines for the Early Management of Acute Ischemic Stroke: A Guideline for Healthcare Professionals From the American Heart Association/American Stroke Association. Stroke. 2019;50(12):e344-e418.
9. Berge E, Whiteley W, Audebert H, et al. European Stroke Organisation (ESO) guidelines on intravenous thrombolysis for acute ischaemic stroke. Eur Stroke J. 2021;6(1).
10. Tomasi S, Sarmientos P, Giorda G, Gurewich V, Vercelli A. Mutant prourokinase with adjunctive C1-inhibitor is an effective and safer alternative to tPA in rat stroke. PLoS One. 2011;6(7):e21999.
11. Li S, Gu HQ, Feng B, et al. Safety and efficacy of intravenous recombinant human prourokinase for acute ischaemic stroke within 4.5 h after stroke onset (PROST-2): a phase 3, open-label, non-inferiority, randomised controlled trial. Lancet Neurol. 2025;24(1):33-41.










































 京公网安备111010602104056
京公网安备111010602104056