科研成果
Nature Communications发表贺文艳等学者文章揭示cTAGE5调控白色脂肪组织发育的新机制
国家神经系统疾病临床医学研究中心贺文艳研究员和中国科学院遗传与发育生物学研究所许执恒研究员团队合作,发现脂肪分化调控关键基因cTAGE5,阐明其通过正向调控胰岛素受体前体的运输,介导脂肪前体细胞骨架重塑和脂解,促进脂肪组织发育,揭示小鼠体内脂肪祖细胞分化与成熟的机制,为白色脂肪组织发育与稳态维持有关的代谢性疾病发生提供理论依据和潜在干预靶点。这一发现7月1日发表在国际学术期刊《自然通讯》(Nature Communications)上。

白色脂肪组织(White adipose tissue,WAT)是重要的代谢和内分泌器官,在机体生长发育、能量供应、激素分泌等方面非常重要,同时,其功能障碍与肥胖、心脑血管病等代谢紊乱有关疾病的发生、发展密切相关。近年,成熟脂肪细胞的稳态维持机制已有较多研究,但脂肪祖细胞体内分化、成熟的关键机制仍未知。
皮肤T细胞淋巴瘤相关抗原5(Cutaneous T-cell lymphoma-associated antigen 5, cTAGE5),也称脑膜瘤表达抗原6(Meningioma expressed antigen 6, MEA6),广泛表达于多种组织,参与细胞内囊泡复合体II(COPII)组装,调控内质网到高尔基体的脂蛋白等运输及分泌。然而,cTAGE5在脂肪祖细胞分化与成熟中的作用目前仍未知。本研究通过构建脂肪祖细胞特异性敲除cTAGE5的小鼠模型(cTAGE5flox/flox; Pdgfra-Cre),首次揭示cTAGE5在脂肪组织发育中的关键作用。课题组研究发现cTAGE5缺失导致白色脂肪组织显著减少、脂肪细胞分化障碍,并引发新生小鼠在3周内的致死表型;而成熟脂肪细胞特异性敲除cTAGE5的小鼠(cTAGE5flox/flox; Adipoq-Cre)则未出现脂肪发育异常表型,上述结果表明cTAGE5特异性调控脂肪祖细胞的分化与成熟过程。
接着,通过转录组测序,研究人员发现调控脂肪祖细胞骨架相关基因的表达显著下调,鬼笔环肽染色证实脂肪分化过程中细胞骨架重塑异常。同时,蛋白质组学结果表明,脂肪组织中脂肪水解通路关键酶ATGL等表达显著上调,脂肪组织和体外分化的脂肪细胞水解增加。并且,体外靶向抑制细胞骨架聚合和水解酶时,可以显著逆转脂肪分化障碍表型。进一步的机制探索,研究人员发现cTAGE5缺失特异性阻滞脂肪祖细胞中胰岛素受体前体(pro-insulin receptor,pro-IR)从内质网向质膜的转运,从而显著抑制PI3K/Akt信号通路活性,破坏胰岛素信号传递,最终导致脂肪分化障碍。
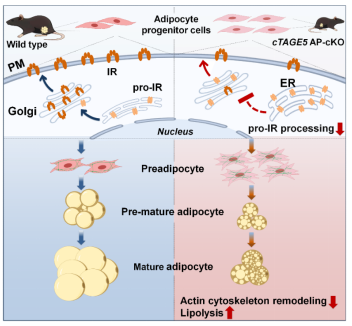
图:cTAGE5通过阻滞脂肪祖细胞中pro-IR从内质网到质膜的转运,导致肌动蛋白骨架重塑异常,脂肪水解增加,最终抑制脂肪生成,损害脂肪组织的发育。(引自Nature Communications 2025, VOL. 16, NO. 5457)
全文链接:https://www.nature.com/articles/s41467-025-60698-1
首都医科大学附属北京天坛医院国家神经系统疾病临床医学研究中心贺文艳研究员和中国科学院遗传与发育生物学研究所许执恒研究员为本文的共同通讯作者,首都医科大学附属北京天坛医院国家神经系统疾病临床医学研究中心范俊婉助理研究员为本文的第一作者兼共同通讯作者。这项工作得到了北京天坛医院国家神经系统疾病临床医学研究中心施福东教授、金薇娜教授,中科院遗传发育所王雅清副研究员、南方医科大学李专教授的大力支持和帮助。











































 京公网安备111010602104056
京公网安备111010602104056